Los icebergs ilustran admirablemente los límites humanos en la exploración de la realidad. Se estima que la fracción visible supone tan solo una octava parte de la totalidad de la masa helada. Es decir, si un humano tuviera que estimar su tamaño o su peso únicamente en función de lo que ve desde la superficie, el error de su estimación se vería gravemente afectado por el hecho de que está soslayando el 87,5% de la realidad.

La ciencia no deja de ser una herramienta humana para descubrir la realidad. Si bien es cierto que mediante la inteligencia pueden superarse ciertos límites de la percepción (tómese como ejemplo el microscopio), en ocasiones ni siquiera esto resulta suficiente para ver en la oscuridad. Estos límites en muchos casos no son infranqueables y tan solo es una cuestión de tiempo: el tiempo necesario para que una inteligencia lúcida encienda la luz. Lo cierto es que muchas inteligencias lúcidas han hecho aportaciones de gran valor a la comprensión del Parkinson. Pero por el momento tan solo se ha alcanzado a ver la superficie y una pequeña fracción del hielo sumergido. Es difícil estimar el tamaño real de este iceberg. Lo importante ahora es tomar una buena dirección en la exploración: es necesario explorar la parte submarina.
El Parkinson
La enfermedad de Parkinson es compleja. En primer lugar, su origen no está del todo claro: la agregación de la proteína α-sinucleína podría tener un papel importante en el inicio de la enfermedad. Esto es un buen comienzo, ya que, de ser así, la investigación podría centrarse en el desarrollo de un tratamiento que disminuyera o deshiciera la agregación de esta proteína. No obstante, por el momento no se ha demostrado que la α-sinucleína sea verdaderamente la piedra angular del Parkinson. En este sentido, es necesario fomentar la investigación fundamental: para encontrar otras posibles vías moleculares implicadas en el inicio del Parkinson por una parte, y para encontrar biomarcadores (moléculas características de la enfermedad fácilmente detectables, por ejemplo mediante un análisis sanguíneo) que permitan un diagnóstico en estadios más tempranos por otra parte. La eficacia de los tratamientos disminuye a medida que el lapso entre la aparición de la enfermedad y la aplicación de éstos aumenta. En el caso del Parkinson, los síntomas empiezan a manifestarse mucho después del verdadero inicio de la enfermedad, por lo que un diagnóstico basado en los síntomas puede considerarse un diagnóstico tardío. Por otro lado, es esencial llevar a cabo ensayos clínicos para evaluar las vías que han sido descubiertas: por ejemplo, en el caso del Parkinson es necesario comprobar si el tratamiento de la agregación de la α-sinucleína consigue curar la enfermedad, si tan solo produce una mejora sintomática, o si no tiene ningún efecto.
El tratamiento de los síntomas versus la cura
En primer lugar, ¿qué se entiende por cura? Según Hauser (2018), la cura del Parkinson deberá caracterizarse por la posibilidad de diagnosticarlo en un estadio lo suficientemente temprano, y por la posibilidad de frenar considerablemente el progreso de la enfermedad. Curar una enfermedad no necesariamente implica erradicarla (Port, 2018). Una mejora sintomática puede considerarse una cura si es lo suficientemente eficaz y estable en el tiempo. Pero no todas las mejores sintomáticas pueden ser consideradas como curas. Por ejemplo, los tratamientos actuales mejoran en algunos casos el estado de los pacientes (disminución de la rigidez, la bradiquinesia y el temblor), pero no consiguen acabar con la enfermedad a largo plazo ni con ciertas características como la neurodegeneración (muerte neuronal). En resumen, todas las curas implican una mejora de los síntomas, pero no todas las mejoras de los síntomas consiguen curar.
La complejidad de las enfermedades neurodegenerativas como el Parkinson se debe a la dificultad de encontrar el origen de todos los eventos patológicos que ocurren en el organismo. Los síntomas visibles son solo una parte de la enfermedad, y son fácilmente detectables cuando la enfermedad alcanza un estadio determinado. Pero hay una serie de eventos moleculares que preceden la aparición de los síntomas que no han sido identificados o que no han sido suficientemente estudiados.
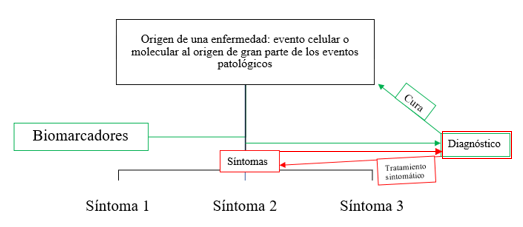
La Figura 2 representa de forma esquemática la lógica del tratamiento de una enfermedad: en un momento determinado, se desencadena la enfermedad por alguna razón (mutación genética, por ejemplo). Esto da lugar a una señalización celular patológica que puede afectar a un gran número de vías moleculares (recuadro superior en la Figura 2). Entre la patología a nivel molecular-celular y la manifestación de los síntomas puede haber un lapso considerable. Por ello, uno de los objetivos de la investigación es encontrar biomarcadores (representados en el recuadro verde a la izquierda en la Figura 2). Por el momento no se ha dado con biomarcadores fácilmente detectables que permitan diagnosticar el Parkinson en sus estadios más tempranos. Un diagnóstico de la enfermedad previo a la aparición de los síntomas permitiría una mayor eficacia de la cura (recuadros verdes a la derecha en la Figura 2).
Por qué no hay una cura para el Parkinson
En la actualidad no contamos con biomarcadores de la enfermedad de Parkinson (existen diversas proposiciones, pero por el momento no hay consenso). Por lo tanto, los diagnósticos se llevan a cabo solo cuando los primeros síntomas se manifiestan, y no cuando la enfermedad comienza a instalarse. Esto tiene consecuencias negativas sobre la eficacia de los tratamientos, que comienzan a administrarse cuando la enfermedad ha progresado demasiado. Asimismo, dado que por el momento no se ha dado con ninguna cura, ésta no es una opción posible una vez realizado el diagnóstico. No obstante, a este nivel existen dos posibilidades para los pacientes de Parkinson: una opción es realizar el clásico tratamiento sintomático. La ventaja es que los problemas motores pueden verse reducidos por un tiempo. La desventaja es que por el momento estos tratamientos son insuficientes, la neurodegeneración sigue aconteciendo y a largo plazo no se habrá hecho ningún progreso. La otra opción consiste en participar en los ensayos clínicos. En la actualidad, hay múltiples ensayos clínicos que prueban diferentes vías terapéuticas para curar el Parkinson. Estos ensayos son la única forma de validar la eficacia de las curas. Así, por más que avance la investigación en busca de las causas del Parkinson, no se llegará a nada si no se demuestra la eficacia terapéutica de los tratamientos que se proponen. La _Figura _3 resume la actualidad de la enfermedad del Parkinson y las acciones posibles tras su diagnóstico.

Tras el diagnóstico, dos vías son posibles: la vía verde consiste en la participación en ensayos clínicos en busca de una cura eficaz contra los agentes que originan la enfermedad. La vía roja (alternativa cuando la vía verde no es posible) consiste en el diagnóstico de la enfermedad tras la manifestación de los signos y en la aplicación de un tratamiento para aliviar los síntomas (en ausencia de cura efectiva). En otras palabras, la vía verde es la esperanza actual para conseguir una cura. Entonces, ¿cuál es problema?
El problema de los ensayos clínicos
A la hora actual contamos con proposiciones de vías terapéuticas (agregación de α-sinucleína, señalización intracelular relacionada con la neurodegeneración de las neuronas dopaminérgicas) y con ensayos clínicos para ponerlas a prueba. Tenemos todos los ingredientes para hacer una pregunta. ¿Por qué no obtenemos una respuesta?
Tal y como explica Hauser (2018) en su contribución a la revista científica Nature, los ensayos clínicos se ven entorpecidos por diversos factores. En primer lugar, Hauser menciona la ya discutida ausencia de marcadores biológicos. El hecho de que los diagnósticos lleguen demasiado tarde y que los pacientes se inclinen por un tratamiento sintomático los inhabilita para participar en los ensayos clínicos. En efecto, uno de los criterios para participar en estos ensayos es la ausencia de medicación sintomática (de lo contrario, sería imposible atribuir un efecto terapéutico a los tratamientos evaluados en los ensayos, ya que no podrían diferenciarse las mejoras debidas a la medicación clásica de las mejoras debidas a la nueva medicación). A esto se unen las trabas temporales: según la publicación, los pacientes diagnosticados en estadios tempranos que deciden participar en los ensayos, lo hacen durante 6 a 12 meses. Más allá de este intervalo temporal, la mayoría de los pacientes opta por comenzar una terapia sintomática para aliviar los signos del Parkinson. Un tiempo de evaluación tan corto dificulta, cuando no imposibilita, el análisis de las diferencias entre los efectos reales de los tratamientos y los efectos debidos al efecto placebo. El autor del artículo solicita a los pacientes y a los profesionales médicos una mayor consideración por el “Año de Oro”, que es el periodo comprendido entre el inicio de la participación en un ensayo clínico (inmediatamente tras el diagnóstico), y el inicio del tratamiento sintomático. En ocasiones, este periodo no es respetado porque el ensayo comienza demasiado tarde (o nunca), o porque el ensayo se abandona demasiado pronto. En pocas palabras, los pacientes elegibles para los ensayos clínicos son escasos.
Tratamientos actuales
Si bien no se ha alcanzado a descubrir una cura para el Parkinson, existen múltiples formas de tratar los síntomas principales. La mayoría de los medicamentos funciona restaurando el déficit de dopamina (consecuencia de la neurodegeneración de las neuronas que la producen), ya que esta es la principal causa de los problemas motores.
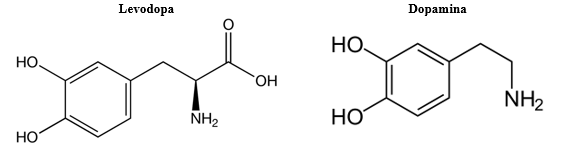
El primer medicamento que salió al mercado fue levodopa, en 1960 (Port, 2018). En aquel entonces fue considerado como la cura del Parkinson. Todavía hoy es considerado como la mejor opción para tratar el Parkinson, ya que es bastante eficaz en los estadios tempranos de la enfermedad. Pero su eficacia no es tan importante a medida que la enfermedad progresa. Levodopa es una molécula similar a la dopamina (ver Figura 3), pero a diferencia de esta última, levodopa es capaz de atravesar la barrera hematoencefálica (tejido endotelial que separa el sistema nervioso del resto del organismo, protegiéndolo de los posibles agentes extraños presentes, por ejemplo, en el sistema sanguíneo). La proximidad estructural a la dopamina y la facultad de levodopa de alcanzar el sistema nervioso a partir del sistema circulatorio hacen de esta molécula un agente terapéutico adecuado para el Parkinson. Una vez en el cerebro, levodopa es transformada en dopamina gracias a la acción de la enzima dopa decarboxilasa. Dicho de otra forma, administrando levodopa a los pacientes de Parkinson, se incrementa la cantidad de dopamina a nivel cerebral. Levodopa es administrado junto con carbidopa (Osmosis, 2019), que no tiene efecto terapéutico de por sí, pero permite el paso de levodopa a través de la barrera hematoencefálica. Este componente es esencial, ya que la enzima dopa decarboxilasa no solo se encuentra en el cerebro, sino también fuera de él. Si esta enzima actúa sobre la levodopa antes de alcanzar el sistema nervioso, ésta es transformada en dopamina (como ya se ha mencionado, incapaz de atravesar la barrera hematoencefálica). El papel de carbidopa es inhibir la acción de la dopa decarboxilasa periférica (en la sangre) para que levodopa pueda llegar intacta al cerebro.
Otra forma de tratar los síntomas del Parkinson es mediante la administración de amantadina (Osmosis, 2019). Esta molécula es utilizada contra las infecciones virales. La amantadina estimula la producción dopaminérgica, pero los mecanismos subyacentes se desconocen por el momento.

Otros tratamientos consisten en estimular los receptores de la dopamina con otras moléculas (agonistas de la dopamina) como la bromocriptina, el pramipexol o el ropinirol. Los agonistas de la dopamina pueden causar efectos secundarios como náuseas, fatiga o tumefacción de las extremidades inferiores (Chou, 2017). Asimismo, es posible incrementar la presencia de dopamina mediante la inhibición de su degradación: ciertas enzimas como las COMT (catecol O-metiltransferasa) degradan tanto la dopamina como la levodopa. Las COMT pueden ser reprimidas mediante moléculas como la entalcapona o la tolcapona. De forma análoga, la seleginina puede utilizarse para inhibir la monoamina oxidasa B, enzima capaz de degradar la dopamina (Osmosis, 2019). Es importante tener en cuenta que ciertos resultados de ensayos clínicos de los inhibidores de la monoamina oxidasa B resultan contradictorios (Chou, 2017).
En el sistema nervioso no solo cuenta la cantidad de una molécula producida: también es importante mantener el equilibrio con respecto a otras moléculas. En contextos no patológicos la cantidad de dopamina es próxima a la de acetilcolina. En los casos de Parkinson, la disminución de la dopamina se traduce como un incremento relativo de la cantidad de acetilcolina. Por esta razón, ciertos anticolinérgicos como la benzotropina pueden ayudar a restablecer el equilibrio inicial disminuyendo la cantidad de acetilcolina (Osmosis, 2019).
Por último, una vía para tratar el Parkinson ligeramente diferente a las propuestas es la estimulación cerebral profunda (Deep Brain Stimulation o DBS). Este método se basa en la estimulación eléctrica para compensar la señalización neuronal patológica del Parkinson (Osmosis, 2019). Este método puede hacer desaparecer el temblor típico del Parkinson (Chou, 2017).
En pocas palabras, las estrategias terapéuticas actuales consisten en administrar dopamina de forma indirecta (mediante levodopa y carbodopa), estimular la producción de dopamina en el cerebro (mediante la amantadina), estimular los receptores de la dopamina (mediante bromocriptina, pramipexol o ropinirol), disminuir su degradación (mediante entalcapona, tolcapona o seleginina), restablecer el equilibrio con respecto a otras moléculas (mediante la benzotropina), o estimular el cerebro directamente para mejorar la señalización neuronal (DBS).
Mensaje para llevarse a casa
Desde sus primeras apariciones en la literatura científica se han hecho numerosos progresos en la comprensión del Parkinson: sus síntomas han sido definidos de forma exhaustiva, ciertos mecanismos moleculares (agregación proteica) y celulares (neurodegeneración) han sido identificados y están siendo explorados en la actualidad. Asimismo, existen ciertas vías terapéuticas para mejorar la calidad de vida de los pacientes de Parkinson. No obstante, hoy en día no contamos con ninguna cura realmente eficaz y duradera. Esto es debido, entre otras razones, a la ausencia de biomarcadores, y por extensión a la ausencia de métodos para detectar el Parkinson de forma precoz. La detección tardía dificulta el buen desarrollo de los ensayos clínicos, ya que los pacientes tienden a elegir las terapias ya existentes para tratar los síntomas motores.
La investigación debe centrarse en el descubrimiento de biomarcadores para diagnosticar el Parkinson en estadios más tempranos, así como en el descubrimiento de otras vías moleculares explicativas de la etiología de la enfermedad. En cuanto a la sociedad, el papel de los profesionales de la salud y de los pacientes no es menos importante. Teniendo en cuenta la dificultad de dar con una cura y de probar su eficacia, debería facilitarse la información relativa a la existencia de ensayos clínicos, para así disminuir el miedo a lo desconocido. Por otra parte, debería ensalzarse la relevancia de estos ensayos a nivel societal, y el gran aporte que cada paciente puede conferir a la ciencia. La exploración del iceberg solo es posible lanzándose al agua.
Chou, K. (2017). Parkinson’s Disease: The Basics [Archivo de vídeo]. Recuperado 24 noviembre, 2019. Fuente
Colaboradores de Wikipedia. (2019a, 18 noviembre). Levodopa. Recuperado 24 noviembre, 2019. Fuente
Colaboradores de Wikipedia. (2019b, 23 noviembre). Dopamina. Recuperado 24 noviembre, 2019. Fuente
Colaboradores de Wikipedia. (2019c, 18 noviembre). Amantadina. Recuperado 24 noviembre, 2019. Fuente
Hauser, R. A. (2018). Help cure Parkinson’s disease: please don’t waste the Golden Year. Nature Partners Journals, 4(1). Fuente
Kils, U. (s.f.). Iceberg. Recuperado 24 noviembre, 2019. Fuente
Osmosis. (2019, 30 julio). Parkinson’s disease - causes, symptoms, diagnosis, treatment & pathology [Archivo de vídeo]. Recuperado 24 noviembre, 2019. Fuente
Port, B. (2018, 3 diciembre). Why isn’t there a cure for Parkinson’s? Recuperado 24 noviembre, 2019. Fuente


